Etileno
Hoje em dia, Etileno é um tema que tem ganhado grande importância na sociedade atual. Durante anos, Etileno tem sido objeto de debate, análise e reflexão em diversas áreas, da política à cultura popular. No entanto, nos últimos tempos, o interesse em Etileno cresceu exponencialmente, tornando-se um tema altamente relevante nas conversas públicas. Seja pelo seu impacto na vida quotidiana das pessoas, pela sua influência no desenvolvimento da tecnologia ou pelo seu papel na evolução do pensamento humano, Etileno tornou-se um elemento fundamental a ter em conta na sociedade moderna. Neste artigo exploraremos diferentes aspectos relacionados a Etileno, analisando sua influência, suas implicações e sua relevância no mundo atual.
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. (Dezembro de 2009) |
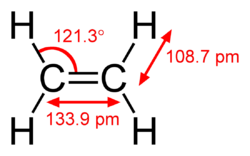
O etileno ou eteno é o hidrocarboneto alceno mais simples da família das olefinas, constituído por dois átomos de carbono e quatro de hidrogênio (C2H4). Existe uma ligação dupla entre os dois carbonos. A existência de uma ligação dupla significa que o etileno é um hidrocarboneto insaturado. Pela nomenclatura IUPAC recebe a denominação de eteno.
A molécula não pode rodar em torno da ligação dupla, e os seis átomos dispõem-se no mesmo plano. O ângulo das duas ligações carbono-hidrogênio é de 117º, muito próximo dos 120º preditos pela hibridização sp² ideal.
É um gás incolor, odor etéreo, levemente adocicado que liquefaz a -103°C e solidifica a -169°C, sendo o composto químico de maior utilização no setor químico industrial.[1]
Obtenção
Destilação seca da hulha
A hulha é aquecida a uma temperatura de 1000°C/1300°C em presença de uma corrente de ar. Obtém-se uma fração gasosa que contém entre 3% a 5% de etileno.
Desidrogenação do etano
Industrialmente o etileno é preparado pela desidrogenação do etano (retirada de hidrogênio). A desidrogenação ocorre entre 500°C e 750°C, utilizando catalisadores como óxido de crômio, de molibdênio, de vanádio e de urânio suspensos em alumina.
Desidratação do álcool etílico
Várias indústrias propõem a fabricação de plástico verde ou ecológico a partir do álcool etílico produzido a partir da cana de açúcar. O método é antigo e semelhante a fabricação de éter etílico (antigamente chamado sulfúrico):
O método é catalisado por ácido sulfúrico ou alumina. A baixa temperatura favorece a produção do éter etílico e alta temperatura favorece o etileno.
Craqueamento do petróleo
Quando moléculas grandes constituintes do petróleo (geralmente alcanos) são quebradas (inglês to crack = quebrar) através de um processo simples de aquecimento utilizando catalisadores (pode ser silica, alumina Al2O3), forma-se uma fração gasosa que contém na sua composição etileno. Esse processo é um dos mais simples que ocorrem com a transformação do petróleo.
Aplicações
O etileno é usado como:
- Anestésico: Em intervenções cirurgicas pode ser usado como anestésico moderado.
- Amadurecimento de frutas: O etileno é produzido naturalmente em plantas, sendo responsável pelo amadurecimento de frutos. É usado para amadurecer de maneira forçada frutas verdes.
- fabricação do polietileno, plástico de amplo uso (as propriedades do polietileno dependem da técnica usada na polimerização).
- Utilizado na mistura denominada MGR (Mixed Gas Refrigerant - gás misto refrigerante), que é fundamental para liquefação do gás natural (GNL) em processos industriais, onde a refrigeração necessária é obtida por uma válvula Joule-Thomson.
A maior aplicação do etileno é através do emprego de derivados obtidos a partir dele:
- Cloreto de etileno: Usado para a produção de tiocol (polissulfeto de polietileno) que é uma borracha sintética.
- Cloreto de vinila: É um monômero para a obtenção do polímero coroscal, vinilite e sarans que são plásticos.
- Óxido de etileno ou epóxido de etileno utilizados como inseticida.
- Obtenção do etileno glicol que é a matéria-prima para a produção de:
- Dinitrato de glicol: Explosivo.
- Diesterato: Plastificante de resinas e lacas.
- Celossolve e metilcelossolve: Solventes de tintas.
- Dietieleno e trietileno: Solventes e plastificantes.
- Ftalato: Plastificante de resinas e plásticos.
- Obtenção de etilenocloridrina como matéria-prima para a obtenção de:
- Ácido acrílico e ésteres: São vidros sintéticos.
- Éteres de glicol: Solvente para vernizes e tintas.
- Dicloroetílico:Solvente para alcatrão, resina ou cera; fumigante para o solo; removedor de mancha para óleo ou graxa.
- Acetato de vinila e éter vinílico: Produção de couros sintéticos, discos, plásticos para moldes e adesivos.
Etileno como hormônio vegetal
Biossíntese
A rota completa de síntese do etileno é um ciclo (ciclo de Yang).O primeiro precursor do etileno nesta via é o aminoácido metionina, o qual é adenilado pela AdoMet sintetase, formando a S-adenosilmetionina. O precursor imediato do etileno é o ácido 1-aminociclopropano-1-carboxílico (ACC) que é sintetizado a partir da AdoMet pela enzima ACCsintase, nesta reação, a adenina é liberada da AdoMet e é ligada à outra molécula de metionina através do ciclo de Yang. A última etapa de síntese do etileno é a conversão do ACC em etileno catalisada pela enzima ACC oxidase.[2]
A etapa limitante para a produção do etileno é a síntese do ACC a partir de AdoMet, que é catalisada pela ACCsintase. Esta enzima tem seus níveis regulados por fatores ambientais e internos, como ferimentos, inundação, estresse hídrico e presença de auxina e é codificada por uma família multigênica divergente, na qual os genes são regulados de formas distintas por indutores diferentes.[2]
Modo de ação
Inicialmente, o Etileno liga-se a um receptor proteico na membrana do Retículo Endoplasmático. Em seguida, esse receptor deixa de ativar uma proteína, a CTR1, que atua como reguladora negativa da cadeia de sinais químicos que produz a resposta biológica do etileno. Em outras palavras, a presença do etileno inativa uma proteína que atua como inibidora, fazendo então com que a resposta ocorra. Na ausência do etileno, a CTR1 inibe a formação dos fatores de transcrição que irão regular a expressão de genes de resposta ao etileno na planta.[3]
Efeitos biológicos
O Etileno regula diversas respostas nos vegetais.[4] O etileno é conhecido como “hormônio do amadurecimento”, pois promove o amadurecimento de frutos através da oxidação de lipídios, quebra das ligações de amido e decomposição da clorofila (molécula responsável pela coloração verde dos vegetais).[5] Isso confere a Outros efeitos biológicos promovidos pelo etileno são: germinação de sementes; epinastia (curvatura para baixo)de folhas; abscisão (queda) de frutos maduros, órgãos senescentes ou danificados e folhas; expansão celular horizontal e crescimento lateral do caule; quebra de dormência de gemas e sementes em algumas espécies; alongamento do caule de espécies vegetais aquáticas submersas; formação de raízes e pêlos absorventes; indução floral e expressão sexual, como por exemplo em Cucurbitaceae (família das abóboras), o etileno induz a preferência de flores femininas. Embora o etileno iniba o florescimento na maioria das espécies, em plantas de abacaxi ele induz o florescimento.[6]
Referências
- ↑ «Propylene Production from Methanol». by Intratec, ISBN 978-0-615-64811-8
- ↑ a b Zeiger, Taiz (2013). Fisiologia Vegetal. Porto Alegre: artmed. pp. 648–649
- ↑ Davies, P.J. Plant Hormones. New York: Springer, 3a Ed., 2010
- ↑ TAIZ, L, ZEIGER, E. Fisiologia Vegetal. Porto Alegre: Artmed, 4ª Ed., 2009
- ↑ «Etileno e o amadurecimento de frutas»
- ↑ RAVEN, P. H., EVERT, F. R., EICHHORN, S. E., Biologia Vegetal. Rio de Janeiro: Guanabara-Koogan, 6ª Ed., 2001