Ácido tereftálico
No mundo atual, Ácido tereftálico tem sido um tema relevante que tem chamado a atenção da sociedade em geral. Com o avanço da tecnologia e da globalização, Ácido tereftálico tornou-se tema de discussão e debate em diversas áreas, da política à ciência, passando pela cultura e entretenimento. À medida que Ácido tereftálico continua a impactar as nossas vidas de formas inesperadas, é crucial explorar as suas implicações e consequências na sociedade contemporânea. Neste artigo, examinaremos mais de perto o fenômeno Ácido tereftálico e sua influência em diferentes aspectos de nossa vida diária.
| Ácido tereftálico | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||
| Nomes | |||||||||||||||||||||
| Outros nomes | ácido 1,4-benzoldicarboxílico para dicarboxil benzeno TPA PTA | ||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Página de dados suplementares | |||||||||||||||||||||
| Estrutura e propriedades | n, εr, etc. | ||||||||||||||||||||
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas | ||||||||||||||||||||
| Dados espectrais | UV, IV, RMN, EM | ||||||||||||||||||||
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão. Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |||||||||||||||||||||
O ácido tereftálico ou ácido 1,4-benzoldicarboxílico é o composto orgânico com a fórmula C6H4(COOH)2 (ou C8H6O4). É formalmente conhecido (IUPAC) como para-dicarboxil benzeno. É um dos três ácidos ftálicos isoméricos. Ele é comercialmente conhecido por seu acrônimo em inglês, PTA (purified terephthalic acid). Este sólido incolor é uma commodity química que tem seu principal uso como precursor na formação do polímero poliéster PET, em combinação com o etilenoglicol, utilizado na produção de vestuário e garrafas plásticas. Vários milhões de toneladas são produzidas anualmente.

Propriedades
Ácido tereftálico é pouco solúvel em água e álcoois, por consequência, até cerca de 1970 a maior parte do ácido tereftálico bruto era convertido no éster dimetílico para purificação. Ele sublima quando aquecido.
Produção
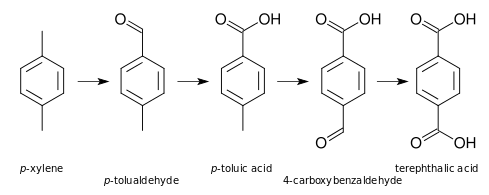
Ácido tereftálico é produzido por oxidação de p-xileno por oxigênio ao ar:
Esta reação processa-se através de um intermediário, ácido p-toluico, que é então oxidado em ácido tereftálico. No ácido p-toluico, a desativação do metil pela remoção de elétrons do grupo ácido carboxílico faz com que o metilo seja um décimo reativo como xileno em si, tornando a segunda oxidação significativamente mais difícil.[3]
O processo industrial utiliza ácido acético como solvente e catalisador, sais compostos de cobalto e manganês, com um promotor brometo. O rendimento é quase quantitativo. A impureza mais problemático é o ácido 4-formilbenzóico (vulgarmente conhecido no campo como 4-carboxibenzaldeído ou 4-CBA), que é removido por hidrogenação de uma solução aquosa quente. Esta solução é, em seguida, resfriada de uma forma gradual para cristalizar o ácido tereftálico de alta pureza.
Apesar dos rendimentos otimizados serem superiores a 95% com uma pureza excelente, a síntese tem provado ter deficiências. Devido à elevada temperatura da reação, cerca de 5% do solvente ácido acético é perdido por decomposição ou "queima". A queima do solvente é um fator econômico significativo no processo de oxidação. Além disso, a perda de produto por descarboxilação a ácido benzóico é comum. A alta temperatura diminui a solubilidade de oxigênio em um sistema já carente de oxigênio. O oxigênio puro não pode ser usado no sistema tradicional, devido aos perigos de inflamáveis misturas orgânicos-O2. O ar atmosférico pode ser utilizado no seu lugar, mas uma vez feito reagir necessita ser purificado de toxinas e depletores de ozônio, tais como bromometano (metilbrometo) antes de ser liberado. Além disso, a natureza corrosiva dos brometos em altas temperaturas requer a reação ser executado em caros reatores construídos de titânio.[4] [5]
Alternativamente, mas não comercialmente significativo, existe o chamado "processo Henkel" ou "processo de Raecke", em homenagem ao titular da empresa e das patentes, respectivamente. Este processo envolve o rearranjo de ácido ftálico em ácido tereftálico através do correspondente sais de potássio.[6][7] O ácido tereftálico pode ser preparado em laboratório pela oxidação de vários derivados de di’’para’’-substituídos do benzeno, incluindo óleo de alcaravia ou uma mistura de cimenos e cuminol com ácido crômico.
Avanços
O uso de CO2 supera muitos dos problemas com o processo industrial inicial. Porque CO2 é um gás melhor inibidor de chama que o nitrogênio, um ambiente de CO2 permite o uso de oxigênio puro diretamente, em vez de ar, com os perigos de inflamabilidade reduzidos. A solubilidade do oxigênio molecular em solução também é reforçada no meio com CO2. Uma vez que mais oxigênio esteja disponível para o sistema, dióxido de carbono supercrítico (Tc = 31 ⁰C) tem oxidação mais completa com menos subprodutos, menor produção de CO, menos descarboxilação e uma pureza mais elevada do que o processo comercial.[4][5]
Quando a reação é executada em água supercrítica, pode ser efetivamente catalisada por MnBr2 com O2 puro em uma temperatura média-alta. A utilização de água supercrítica, em vez de ácido acético como solvente, diminui o impacto ambiental e oferece uma vantagem de custo. No entanto, o alcance de tais sistemas de reação é limitado pelas condições ainda mais extremas do que o processo industrial (T = 300−400 °C, P > 200 bar).[8]
Cetonas tem sido eficientes em atuar como promotoras para a formação do catalisador ativo de Co(III). Em particular, as cetonas com metileno a oxidam grupos hidroperóxidos que são conhecidos por oxidar Co(II). Cetonas viáveis tem sido butanona, triacetilmetano (TAM), 2,3-pentanodiona (2,3-PD), e acetilacetona; todos as quais podem estabilizar a formação de radicais por meio de ressonância.[4]
As reações que ocorrem a temperaturas tão baixas quanto 100 ⁰C são possíveis usando sais de zircônio como um co-catalisador no lugar de brometo e acetato de manganês. Pensa-se que o Zr(IV) age oxidando Co(II) ao Co(III) ativo. Isto sozinho reduz o período de indução, e foi demonstrado ter um efeito sinérgico com cetonas. No entanto, uma quantidade maior de acetato de cobalto é necessária do que no processo industrial comum e é ineficaz acima de 160 ⁰C.[3]
A adição de uma pequena porção de metaloporfirina, em particular T(p-Cl)PPMnCl, tem um efeito cocatalítico com o catalisador tradicional Co(OAc)2. Isto requer menos ácido acético e não requer brometos. O efeito catalítico tem sido atribuído à facilidade de formação de peróxido sobre a metaloporfirina.[9][10]
Mecanismo
A auto-oxidação de p-xileno é conhecida como ocorrendo através de um processo de radical livre. Os metais Mn(III) e Co(III) por si só não são oxidantes fortes o suficiente para iniciar a reação em cadeia de radicais, mas em vez disso eles iniciam através da formação de radicais de bromo a partir dos íons em solução. Estes radicais de bromo, então, decompõe os hidroperóxidos que são ligados aos metais, bem como subtraem hidrogênios de grupos metilo no p-xileno formando radicais livres e propagam a reação. A seguir, são apresentados os passos de iniciação, propagação e terminações propostos para a primeira de quatro oxidações envolvidas na auto-oxidação:
Oxidação de p-xileno a p-tolualdeído
Iniciação
- Mn(III)/Co(III) + Br• → Mn(II)/Co(II) + Br-
Propagação
- Br- + H3-Ph-CH3 → Hbr + H3-Ph-CH2•
- H3-Ph-CH2• + O2 → H3-Ph-CH2O2•
- H3-Ph-CH2O2• + Mn(II)/Co(II) + H+ → H3-Ph-CHO + Mn(III)/Co(III) + H2O
- H3-Ph-CH2O2• + Mn(II)/Co(II) + H+ → H3-Ph-CH2OOH + Mn(III)/Co(III)
- H3-Ph-CH2OOH + Mn(II)/Co(II) + H+ → H3-Ph-CHO• + Mn(III)/Co(III) + H2O
Terminação
- Br• + H3-Ph-CH2• → H3-Ph-CH2Br
- Br• + H3-Ph-CH2O2• → H3-Ph-CH2O2Br
Mn()/Co() - tanto manganês como cobalto podem estar envolvidos na reação
A reação em cadeia de radicais prossegue através de uma série de intermediários, a partir da oxidação de p-xileno a p-tolualdeído (TALD), então ácido p-toluico (PT), 4-carboxibenzaldeido (4-CBA), e finalmente ao produto ácido tereftálico (TA).
A cinética da oxidação é extremamente complexa, mas uma compreensão geral do mecanismo tem sido estabelecida.[11]
Aplicações
Virtualmente todo o fornecimento mundial de ácido tereftálico e dimetil tereftalato são consumidos como precursores para politereftalato de etileno (PET). A produção mundial em 1970 foi de cerca de 1,75 milhões de toneladas.[12] Em 2006, a demanda global de ácido tereftálico purificado (PTA) ultrapassou 30 milhões de toneladas.
Existe uma procura menor de ácido tereftálico, mas mesmo assim significativa, na produção de tereftalato de polibutileno e vários outros polímeros de engenharia.[13]
Em laboratórios de pesquisa, o ácido tereftálico foi popularizado como um componente para a síntese de estruturas de metal-orgânicos.
A droga analgésica oxicodona, ocasionalmente é comercializada como um sal de tereftalato, no entanto, o sal de oxicodona mais usual é o cloridrato. Farmacologicamente, um miligrama de terephthalas oxycodonae é equivalente a 1.13 mg de hydrochloridum oxycodonae.
Ácido tereftálico é usado como carga em algumas granadas de fumaça militares, mais notavelmente a granada de fumaça estadunidense M83, produzindo uma fumaça branca grossa quando queimada.
Referências
- ↑ Sheehan, R.J. Terephthalic acid, dimethyl phthalate and isophthalic acid. In: Ullmann's encyclopedia of industrial chemistry. 5th completely revised ed. Vol. A 26. VCH Verlagsgesellschaft, 1995. p. 193-204
- ↑ «Ácido tereftálico» (em inglês)
- ↑ a b Y. Xiao, W. P. Luo, X. Y. Zhang, C. C. Guo, Q. Liu, G. F. Jiang and Q. H. Li (2010). «Aerobic Oxidation of p-Toluic Acid to Terephthalic Acid over T(p-Cl)PPMnCl/Co(OAc)2 Under Moderate Conditions». Catalysis Letters. 134 (1,2): 155–161. doi:10.1007/s10562-009-0227-1
- ↑ a b c Zuo, Xiaobin, Bala Subramaniam, and Daryle H. Busch (2008). «Liquid-Phase Oxidation of Toluene And-toluic Acid under Mild Conditions: Synergistic Effects of Cobalt, Zirconium, Ketones, and Carbon Dioxide». Industrial & Engineering Chemistry Research. 47 (3): 546–552. doi:10.1021/ie070896h
- ↑ a b Zuo, Xiaobin, Fenghui Niu, Kirk Snavely, Bala Subramaniam, and Daryle H. Busch (2010). «Liquid Phase Oxidation of P-xylene to Terephthalic Acid at Medium-high Temperatures: Multiple Benefits of CO2-expanded Liquids». Industrial & Engineering Chemistry Research. 12 (2): 260–67. doi:10.1039/B920262E
- ↑ Yoshiro Ogata, Masaru Tsuchida, Akihiko Muramoto (1957). «The Preparation of Terephthalic Acid from Phthalic or Benzoic Acid». Journal of the American Chemical Society. 79 (22): 6005–6008. doi:10.1021/ja01579a043
- ↑ Yoshiro Ogata, Masaru Hojo, Masanobu Morikawa (1960). «Further Studies on the Preparation of Terephthalic Acid from Phthalic or Benzoic Acid». Journal of Organic Chemistry. 25 (12): 2082–2087. doi:10.1021/jo01082a003
- ↑ Pérez, Eduardo, Joan Fraga-Dubreuil, Eduardo Garcia-Verdugo, Paul A. Hamley, W. Barry Thomas, Duncan Housley, Wait Partenheimer, and Martyn Poliakoff (2011). «Selective Aerobic Oxidation of Para-xylene in Sub- and Supercritical Water. Part 1. Comparison with Ortho-xylene and the Role of the Catalyst». Green Chemistry. 13 (12): 2389–2396. doi:10.1039/C1GC15137A
- ↑ Y. Xiao, W. P. Luo, X. Y. Zhang, C. C. Guo, Q. Liu, G. F. Jiang and Q. H. Li (2010). «Aerobic Oxidation of p-Toluic Acid to Terephthalic Acid over T(p-Cl)PPMnCl/Co(OAc)2 Under Moderate Conditions». Catalysis Letters. 134 (1,2): 155–161. doi:10.1007/s10562-009-0227-1
- ↑ Jiang, Quan, Yang Xiao, Ze Tan, Qing-Hong Li, and Can-Cheng Guo (2008). «Aerobic Oxidation of P-xylene over Metalloporphyrin and Cobalt Acetate: Their Synergy and Mechanism». Journal of Molecular Catalysis A: Chemical. 285 (1,2): 162–168. doi:10.1016/j.molcata.2008.01.040
- ↑ Wang, Qinbo, Youwei Cheng, Lijun Wang, and Xi Li (2007). «Semicontinuous Studies on the Reaction Mechanism and Kinetics for the Liquid-Phase Oxidation Of-Xylene to Terephthalic Acid». Industrial & Engineering Chemistry Research. 46 (26): 8980–8992. doi:10.1021/ie0615584
- ↑ Richard J. Sheehan, "Terephthalic Acid, Dimethyl Terephthalate, and Isophthalic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a26_193 Article Online Posting Date: June 15, 2000.
- ↑ Ashford's Dictionary of Industrial Chemicals, Third edition, 2011, page 8805
Ligações externas e leituras extras
- Basic Organic Chemistry: Part 5, Industrial Products, J.M. Tedder, A. Nechvatal, A.H. Tubb (editors), John Wiley & Sons, Chichester, UK (1975).
- International Chemical Safety Card 0330 - www.inchem.org